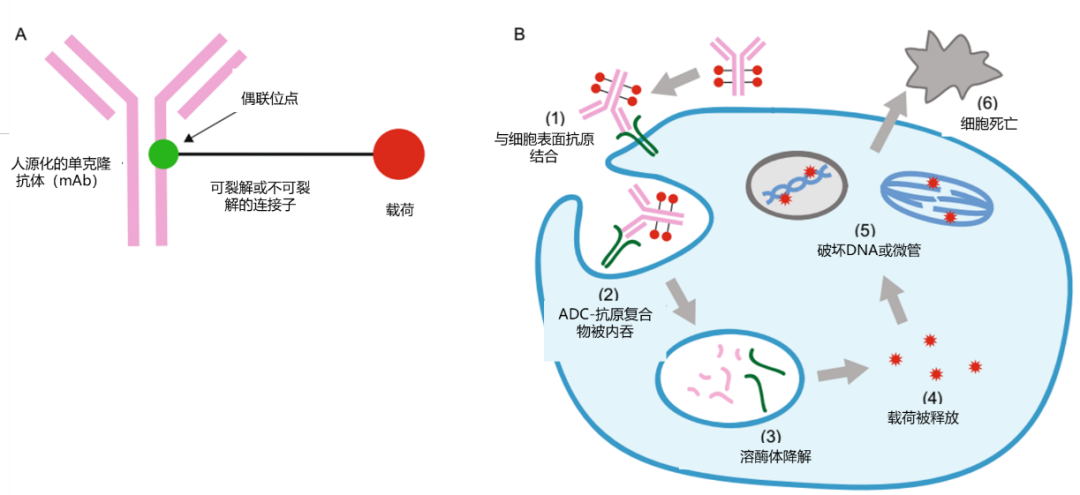
TRAStuzumab-Deruxtecan (T-DXd)是新一代抗体药物偶联物(ADC)的代表,抗体部分为曲妥珠单抗,能靶向HER2受体,具有抗体依赖性细胞介导的细胞毒作用(ADCC),携带载药后结构性质依然稳定。它的专有载药DXd是一种拓扑异构酶Ⅰ抑制剂,具有极高的抗肿瘤活性,并且细胞膜渗透性良好使其具有旁观者效应,代谢迅速使其安全性可控。此外,T-DXd还具有可裂解的四肽连接子,在血液循环中结构稳定,药物脱落率低,进入肿瘤细胞后能迅速释放载药,且药物抗体比(DAR)达8,超越以往的ADC药物。总之,T-DXd具有多种独特的属性。 图1. T-DXd结构示意图及相关特征 前言 ADC药物已经登上抗肿瘤药物的主流舞台,为了在安全性和有效性之间达到最佳平衡,ADC每个组成部分的持续优化是促进ADC药物日益成功的不竭动力。在充分吸取第一代、第二代ADC研发经验教训的基础上,新一代ADC药物已经惊艳亮相,有望引领ADC药物新时代。 ADC药物的发展回顾 抗体药物偶联物(ADC药物) 由单克隆抗体、连接子和载药(细胞毒药物)三部分构成,通过单克隆抗体特异性地结合肿瘤细胞表面高表达的靶抗原,经抗原介导的内化作用进入肿瘤细胞,在溶酶体降解作用下释放细胞毒药物,杀死肿瘤细胞。ADC药物兼具抗体的高特异性和细胞毒药物的高抗肿瘤活性,同时,因其定向释放的特性而具有更加可控的安全性,是目前肿瘤治疗领域的热点研究方向[1]。 图2. ADC药物组成及作用机制 ADC药物在早期阶段的研发探索,以BR96-Dox作为代表,它的问世意味着ADC药物走向临床。但是早期ADC药物使用的单克隆抗体主要是鼠源单抗,存在人抗鼠免疫反应,造成药物难以到达标靶,并且细胞毒药物的生物活性低、选择性差,早期ADC药物具有很大的局限性。 第一代ADC药物以辉瑞的Gemtuzumab Ozogamicin为例,预示着 ADC 全面发展的时代已经来临。但由于连接子不稳定,导致药物血清中过多解离带来安全性和治疗性的削弱,Gemtuzumab Ozogamicin被撤回上市。在辉瑞调整过给药方案后,才得以重新上市(点击“阅读原文”)。Brentuximab vedotin和T-DM1作为第二代ADC药物的代表,其成功问世标志着ADC药物技术逐渐成熟。但是仍然面临着脱靶毒性、载药量不均一、DAR低等不足之处(点击“阅读原文”)。随着制备技术的不断发展,新一代ADC药物开始崛起[2,3]。 表1. 目前已经上市的部分ADC药物概览 新一代ADC药物的优化探索 ADC 研发技术不断发展的本质也是抗体、连接子和细胞毒药物不断发展的过程。相比第二代ADC,新一代ADC药物的主要攻关方向在于肿瘤特异性高且均一表达抗原的精确识别、创新连接子和偶联位点技术的开发、具有更高效细胞内和旁细胞毒性药物的探索[4]。 目前新一代ADC药物在抗体上,选择人源化或全人源单克隆抗体分子,特异性地结合肿瘤细胞而对正常细胞没有交叉反应,且血液半衰期长,疗效和安全性更高,已经成为ADC药物发展的主要趋势。并且,为了增加病灶靶细胞的结合特异性和药物在病灶区域的富集能力,双特异抗体被应用于新一代ADC药物的设计开发。此外,小型化抗体,如:Fab抗体、单链可变片段 ScFv 以及纳米抗体因其较强的实体肿瘤穿透力和较快的肾脏清除率,在改善治疗窗方面也为新一代 ADC 药物设计提供了选择[5.6]。 在连接子上,新一代ADC药物采用的是可裂解连接子,既保持了ADC 药物在血液循环中的稳定性,又可使细胞毒药物在肿瘤部位快速释放,同时药物以活性结构释放而不带有任何的附加修饰,较好的保持了药物分子的理化特性和活性。此外,与不可裂解连接子相比,具有可裂解连接子的ADC对靶抗原表达的依赖性较小[7]。 在偶联方式上,既往ADC药物采用非定点偶联,得到的ADC最终产物是DAR不一致、偶联位点不一的混合物。而新一代ADC药物采用定点偶联,能在特定位点实现细胞毒素的连接,获得的ADC药物具有合适的DAR(4-8),均一性高,稳定性好,在血液中不容易脱落[8,9]。 此外,在载药上,新一代ADC药物采用了更高活性的细胞毒药物,如安曲霉素类衍生物PBD(pyrrolobenzodiazepine,吡咯并苯并二氮杂?)、喜树碱类(CPT)衍生物SN-38等,其中PBD二聚体对于多种肿瘤细胞系(如乳腺癌细胞 MCF-7、卵巢癌细胞 A2780 等)的活性能达到pmol/L 级别。SN-38是抗癌前药伊立替康的活性代谢物,通过抑制DNA拓扑异构酶I (TOP1)发挥作用,活性约比伊立替康强三个数量级。并且新一代ADC药物的载荷具有较高的细胞膜渗透性,因而能发挥强效的旁观者效应,针对异质性肿瘤具有较大的应用潜力[5]。 图3. ADC药物的优化探索 T-DXd具有多重独特属性 T-DXd是由抗HER2的人源抗体和 I 型拓扑异构酶抑制剂通过基于四肽的可裂解连接子偶联而成的新一代 ADC药物。T-DXd在HER2表达的肿瘤细胞特异性内吞后被溶酶体蛋白酶切割,释放出活性载药,发挥抗肿瘤效应。其抗体部分为曲妥珠单抗,保留了ADCC效应,携带载药后结构性质依然稳定[9]。 T-DXd的活性载药DXd由SN-38结构改造而来,属于一种水溶性的CPT衍生物,具有抑制拓扑异构酶I的广谱抗癌作用。其活性是SN-38的10倍,是传统化疗如紫杉醇和阿霉素的100-1000倍,抗肿瘤活性远超目前常见的细胞毒药物。ADC药物的有效荷载从作用机制上通常可分为两大类:微管抑制剂和DNA损伤剂,而DXd通过抑制拓扑异构酶Ⅰ,从而阻断DNA复制,与其他ADC有效载荷以及乳腺癌常见化疗药物作用机制不同,能够有效避免交叉耐药。且对药物泵P-gp高表达的肿瘤(常见化疗耐药机制之一),Dxd仍然有效。此外,注射T-DXd后,游离DXd浓度极低,且代谢迅速,能保证其高活性下的安全性[10,11]。 图4. DXd/Dx-8951f的结构优化过程 T-DXd使用创新的连接子技术:酶切四肽(GGFG)连接子,其中GGFG可以被溶菌酶选择性地裂解,将药物定向释放到肿瘤组织。与传统氨基苄基 (PAb)连接子相比,这种基于GGFG四肽的可裂解连接子,疏水性更低,在血液中高度稳定,21天血浆中DXd释放率仅1.2%-3.9%,而T-DM1在4天时载荷释放率已高达18.4%[10,12]。 图5. 优化的基于GGFG四肽的可裂解连接子 T-DXd的偶联方式为半胱氨酸偶联,半胱氨酸残基的巯基是活性很强的官能团,但并不天然存在,需要将IgG1中的4个链间二硫键还原得到,而肽链内的12个二硫键却不易被还原,因此,可以得到8个巯基基团与连接子偶联,丰度较低,更容易控制,得到的产物均一性较高。相比之下,T-DM1采用抗体表面的赖氨酸残基作为偶联位点,而已知抗体所有结构域>80个赖氨酸残基中约有>20个可用的偶联位点,即与抗体偶联的载荷数以及连接位点有多种可能性,最终T-DM1偶联产物为DAR分布于0-7的混合物[9,10]。 图6. IgG1结构中的二硫键 T-DXd的每个抗体与8个DXd分子偶联,其DAR值比一般ADC(2-4,T-DM1为3.5)要高得多。虽然有研究报道,较高的DAR导致较高的血浆清除率并促进脱靶效应,但T-DXd稳定的连接子突破DAR限制,达到高DAR的同时减少抗体聚集。前期研究表明,T-DXd在体内外均有较强的疗效和可接受的聚集率,小鼠耐受性良好。较高的DAR也确保了虽然较少的T-DXd附着在HER2低表达的癌细胞表面,但仍可携带足够的有效载荷进入靶细胞,从而有效杀死癌细胞。一项研究证实,T-DXd对所测HER2低表达肿瘤细胞系的抑制效果优于低DAR的ADC药物[7]。 更值得一提的是,T-DXd还具有旁观者效应,即在异质性肿瘤中,除直接杀伤靶抗原阳性细胞外,还可杀伤邻近抗原阴性或是低表达的肿瘤细胞。虽然T-DM1也是ADC,但T-DM1释放的lys-smcc-DM1膜通透性为零。研究表明,在体外条件下,T-DM1对KPL-4细胞(HER2+)或MDA-MB-468细胞(HER2-)混合物中的HER2-细胞没有杀伤作用,而T-DXd对两种细胞均有杀伤作用。在体内研究中,将NCI-N87细胞(HER2+)和MDA-MB-468-Luc细胞(HER2-)混合接种于BALB/c裸鼠,发现只有T-DXd能降低小鼠携带的肿瘤细胞中的荧光素酶信号。然而,T-DM1不能降低荧光素酶信号,这表明T-DM1具有较低的膜通透性,因此不能引起旁观者效应。而T-DXd释放的DXd,化学性质独特,使其具有良好的细胞膜渗透性,因而能发挥显著的旁观者效应[7,10]。 图7. T-DXd/DS-8201的旁观者效应 T-DXd有望引领ADC药物的新时代 基于T-DXd多种独特属性,在包括乳腺癌、胃癌、肺癌、肠癌领域等均表现出较强的抗肿瘤活性。 针对HER2阳性晚期乳腺癌,T-DXd表现尤为出众。2017年8月获得FDA突破性疗法认证,2019年10月获得优先审评资格,并于2019年12月获得FDA批准用于HER2阳性晚期乳腺癌的后线治疗。其关键研究DESTINY-Breast01[13]表明,针对T-DM1耐药的HER2阳性晚期乳腺癌,客观缓解率(ORR)高达61.4%(包括12例CR),更新的中位无进展生存期(PFS)长达19.4个月,且安全性良好。研究结果多次亮相于各大乳腺癌相关肿瘤会议。这些出色表现提示T-DXd可作为更加优化的HER2阳性晚期乳腺癌治疗策略之一。 一项开放标签、剂量递增和剂量扩展的I期试验[14]中,T-DXd在至少经两种治疗进展的晚期HER2阳性胃癌患者中显示出初步的抗肿瘤活性和可管理的安全性,ORR达43.2%。该试验令人鼓舞的初步结果使得T-DXd被日本厚生劳动省认定为治疗HER2阳性晚期胃癌或胃食管交界癌的SAKIGAKE(一种加速审查方案)。目前T-DXd用于HER2阳性胃癌的 II 期临床研究也已达到临床终点[15]。 在肺癌领域,一项I期研究表明T-DXd针对NSCLC的ORR高达62.5%,疾病控制率(DCR)达75.0%,结果说明T-DXd针对NSCLC患者同样具有良好的抗肿瘤活性[16],且针对复发难治性NSCLC的Ⅱ期研究正在开展中[17]。 在肠癌领域,DESTINY-CRC01研究是一项T-DXd治疗HER2表达、RAS-野生型结直肠癌的Ⅱ期、开放标签的多中心研究,78例入组患者均接受过至少2线治疗方案出现进展,先前方案的中位线数为4。在数据截止日,确认的ORR在HER2阳性队列为45.3%,包括1例完全缓解,23例部分缓解。既往接受过抗HER2治疗的患者ORR为43.8%。DCR为83.0%;中位PFS为6.9个月;中位OS未达到。总体上,T-DXd 在HER2表达的结直肠癌患者标准化治疗方面显示了非凡的活性,安全性与之前的结果一致[18]。 总之,T-DXd作为新一代ADC药物的代表,抗肿瘤活性和安全性得到了显著提高,目前已经在多个癌种均有布局,疗效成果令人称赞,具有广阔的应用前景。 专家介绍 宗红教授 郑州大学第一附属医院、肿瘤科一病区主任、医学博士、硕士研究生导师 中国老年学和老年医学学会精准医疗分会常务委员 河南省抗癌协会大肠癌专业委员会副主任委员 河南省医学会肿瘤医学分会副主任委员 中国医师协会肿瘤医师分会乳腺癌学组委员 中国抗癌协会肿瘤麻醉与镇痛专业委员会委员 [1]Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46. [2]Abdollahpour-Alitappeh M, Lotfinia M, Gharibi T, et al. Antibody-drug conjugates (ADCs) for cancer therapy: Strategies, challenges, and successes. J Cell Physiol. 2019 May;234(5):5628-5642. [3]Joubert N, Beck A, Dumontet C, et al. Antibody-Drug Conjugates: The Last Decade. Pharmaceuticals (Basel). 2020 Sep 14;13(9):245. [4] 中国抗癌协会肿瘤药物临床研究专业委员会等. "抗体药物偶联物治疗恶性肿瘤临床应用专家共识(2020版)." 中华肿瘤杂志 43.01(2021):78-91. [5] Beck A, Goetsch L, Dumontet C, Corvaïa N. Strategies and challenges for the next generation of antibody-drug conjugates. Nat Rev Drug Discov. 2017 May;16(5):315-337. [6]朱梅英. 抗体药物偶联物:肿瘤治疗领域的“魔术子弹”. 药学进展,2021,45(03):161-166. [7] Xu Z, Guo D, Jiang Z, et al. Novel HER2-Targeting Antibody-Drug Conjugates of Trastuzumab Beyond T-DM1 in Breast Cancer: Trastuzumab Deruxtecan(DS-8201a) and (Vic-)Trastuzumab Duocarmazine (SYD985). Eur J Med Chem. 2019 Dec 1;183:111682. [8]李明莹,汪琳,马宁宁. 定点偶联技术在抗体药物偶联物中的应用. 药学进展,2021,45(03):180-187. [9]Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin Cancer Res. 2016 Oct 15;22(20):5097-5108. [10] Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185. [11] Chau CH, Steeg PS, Figg WD. Antibody-drug conjugates for cancer. Lancet. 2019 Aug 31;394(10200):793-804. [12] Nakada T, Masuda T, Naito H, et al. Novel antibody drug conjugates containing exatecan derivative-based cytotoxic payloads. Bioorg Med Chem Lett. 2016 Mar 15;26(6):1542-1545. [13]Modi S, Saura C, Yamashita T, et al. DESTINY-Breast01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621. [14] K. Shitara, H. Iwata, S. Takahashi, et al, Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study, The Lancet. Oncology, 20 (2019) 827-836. [15] K. Yamaguchi, Y.-J. Bang, D. Sakai, et al, A randomized phase 2, multicenter, open-label study of trastuzumab deruxtecan (DS-8201a) in subjects with HER2-expressing gastric cancer, Journal of Clinical Oncology, 36 (2018). [16] J. Tsurutani, H. Park, T. Doi, et al, Updated Results of Phase 1 Study of DS-8201a in HER2-Expressing or - Mutated Advanced Non-Small-Cell Lung Cancer, Journal of Thoracic Oncology, 13 (2018) S324-S324. [17] P. Janne, B. Li, H. Murakami, et al, A Phase 2 Study of DS-8201a in HER2-Overexpressing or -Mutated Advanced Non-Small-Cell Lung Cancer, Journal of Thoracic Oncology, 13 (2018) S476-S476. [18] Siena S, Di Bartolomeo M, Raghav K, et al. DESTINY-CRC01 investigators. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial. Lancet Oncol. 2021 May 4:S1470-2045(21)00086-3.